Хімія – наука про речовину. Уроки хімії Йодом змочимо ми рясно, щоб було все стерильно
Коли ми чуємо слово «хімія», одразу уявляємо людину, оточену колбами, пробірками, наповненими речовинами всіляких кольорів. Він записує незрозумілі символи, які нам здаються ієрогліфами. Перед нами постає питання: що це за наука, які вивчає завдання? Відповідь досить проста, предмет хімії - речовини.
Хімія — наука про речовини, їх властивості та перетворення на інші речовини.
Як і кожна наука, хімія має власну історію розвитку. Перші хімічні знання з'явилися до нашої ери, у Стародавньому Єгипті. Єгиптяни мали хімічну науку, яку називали «Священним мистецтвом». Деякі рецепти приготування парфумерії та лікарських препаратів використовують і досі. Напевно ви чули про алхіміки та філософський камінь, за допомогою якого, можна перетворити будь-який метал на золото.
У сучасному уявленні термін «хімія» можна почути у кількох інтерпретаціях: хімія як наука, і навіть продукти хімічного виробництва (одним словом хімія). Ми не уявляємо наше існування без хімічних речовин. Прокидаючись вранці, йдемо вмиватися: мило, зубна паста чекають на нас у ванній кімнаті. Ароматний чай і хрусткі пластівці на сніданок. Одяг, взуття, шкільне приладдя та багато іншого ми отримуємо завдяки хімічним технологіям.
Але також можна сказати, що хімія – це шкода. Неодноразово чули про кислотні дощі, про загибель морських мешканців через нафтові плями, про нітрати в овочах та фруктах тощо.
Хімія тісно пов'язана з людством, є його невід'ємною частиною. Щоб не завдавати шкоди нашій планеті, необхідно застосовувати хімічні знання та раціонально використовувати речовини.
Саме завдяки своїй багатогранності хімія застосовується у кожній області:
- Медицина: лікарські засоби, вакцини, штучні органи, косметичні засоби;
- Мистецтво: живопис, архітектура, фотографії, ювелірні вироби, кування, лиття;
- Сільське господарство: добрива, засоби для боротьби зі шкідниками;
- Криміналістика: упізнання особи за ДНК, відбитками пальців, визначення складу отруйних та вибухових речовин;
- Будівництво: виробництво будівельних матеріалів; обробка деревини;
- Металургія: без металів немає жодна галузь. Метали та сплави оточують нас всюди;
- У побуті: засіб побутової хімії, для приготування обіду також застосовуємо хімічні знання;
- Харчова промисловість: молочна, м'ясна продукція, соуси, кондитерські вироби тощо;
- Охорона навколишнього середовища. На даний момент гостро постає проблема охорони навколишнього середовища. Діяльність людини згубно діє планету. Але за допомогою хімічних знань, що базуються на властивостях речовин, вчені знаходять способи очищення води, ґрунту, повітря від шкідливих речовин.

()
Хімія - наука дуже велика і включає багато розділів, які мають своє призначення і вивчають речовини, їх будову і властивості.
- Неорганічна хімія або її називають хімія неживої природи. Предмет вивчення хімічних елементів та їх сполук;
- Біохімія вивчає процеси, що відбуваються в організмах при обміні речовин, диханні тощо;
- Органічна хімія чи хімія вуглецю. Це захоплюючий розділ знайомить про безліч сполук завдяки унікальним властивостям вуглецю;
- Фізична хімія розглядає закономірності реакцій;
- Аналітична хімія завдяки якісному та кількісному аналізу дозволяє досліджувати суміші.
Щоб опанувати хімічні знання, необхідно вивчити фізику, біологію, а також математику. Як видно із схеми, хімія тісно перегукується з іншими науками.

()
Атомно-молекулярне вчення. Найдрібніші частинки
Як і кожна наука, хімія має свої терміни та поняття, які вивчаються протягом усього курсу. Ці терміни для вас будуть не новими, ви з ними знайомилися на уроках фізики та природознавства. А мова піде про атоми, молекули, хімічні елементи та речовини. Ці поняття є основою атомно-молекулярного вчення.
Розглянемо докладно кожне поняття.
атом
Напевно, ви в підручнику або кабінеті хімії бачили періодичну систему хімічних елементів (ПСХЕ). Вона має різний вигляд і структуру, з якою ви пізніше докладно познайомитеся. Класичний вид періодичної системи хімічних елементів зображено малюнку.

()
З уроків природознавства вам відомо, що це цеглинки світобудови.
Атом - найдрібніша частка хімічного елемента, яка відповідає за його властивості та хімічно неподільна.
На даний момент відомо 126 видів атомів – хімічних елементів. Який зв'язок між хімічним елементом та атомом? Хімічний елемент складається з атомів певного виду. У чому полягає відмінність цих понять. Чому алхіміки було неможливо знайти філософський камінь? Чому залізо чи мідь не перетворюються на золото? Щоб відповісти на ці питання, необхідно розглянути будову атома.
Абсолютно кожен атом має позитивно заряджене ядро і негативні електрони, що обертаються навколо нього.

( , переклад адміністрації сайту )
Найважче в атомі – це ядро, яке складається з протонів (мають заряд +) та нейтронів (заряд 0).
Атом немає ніякого заряду, інакше кажучи нейтральний.
Число протонів = число електронів
Щоб дізнатися кількість частинок, необхідно визначити порядковий номер елемента ПСХЕ .
Наприклад, якщо до складу атома входить 10 електронів та 10 протонів, подивившись у періодичну систему, побачимо, що даний набір частинок відповідає хімічному елементу – Неон. Хімічний елемент Золото має 79 протонів та 79 електронів. Склад атомів, а точніше кількість протонів, не змінюється в ході хімічних реакцій. Саме з цієї причини алхіміки не змогли знайти рецепт філософського каменю.
Атоми (подібно до літер, які з'єднуються в склади, а потім у слова) з'єднуються в молекули.
Молекула
Молекула – найменша частка речовини
Як утворюються молекули? Знову проведемо аналогію з літерами. Щоб вийшло читане і зі змістом слово, необхідна певна комбінація літер та чіткі правила. Також відбувається і за утворення молекули. Атоми з'єднуються у молекулу за допомогою хімічних зв'язків. Властивості молекул залежать від того, атоми яких елементів входять до їх складу, а також як вони з'єднані між собою.
Розглянемо з прикладу молекул речовин, які утворені атомами кисню, це кисень і озон. Обидві ці молекули утворені атомами хімічного елемента Кисень, але до складу озону, хімічна формула якого О 3 входить 3 атома Кисню, а в молекулу кисню, формула речовини О 2 - два атоми хімічного елемента Кисень.

()
Це явище називається алотропією. Це явище існування простих речовин, утворених однаковим хімічним елементом, але різним за властивостями та будовою.
Рекордсменом за утворенням алотропних форм є вуглець, який існує у вигляді алмазу, графіту, карбину, фулеренів, вуглецевих нанотрубок.
Як видно з визначення, атоми та молекули - це частинки, але в чому їхня різниця? Знову проведемо аналогію з літерами та словами. Літери – це атоми, слова – це молекули. Літери не можуть складатися зі слів, так само як і атоми не можуть складатися з молекул.

()
Молекула сірчистого газу SO 2 складається з одного атома Сірки та двох атомів Кисню. Молекула аміаку складається з одного атома Азоту і трьох атомів Гідрогену і т.д.
Отже, бачимо, що це речовини складаються з атомів хімічних елементів. Жива та нежива природа – це також комбінація хімічних елементів.
Іони
Що відбувається з атомом, якщо він приєднує чи віддає електрони? Він стає зарядженою часткою.

()
Іони- Частки, які позитивно або негативно заряджені.
Узагальнивши все вищесказане, виділимо основні постулати атомно-молекулярного вчення, яке є фундаментом у хімії, фізиці та природознавстві:
- Речовини складаються з молекул;
- Атоми є частиною молекули;
- Атомам і молекул характерно мимовільний рух;
- Під час хімічних реакцій відбувається зміна складу молекули та утворюються нові речовини.
Речовина. Класифікація речовин
Від активності хімічних елементів залежить - існуватимуть вони у вільному вигляді або будуть частиною речовини.
Речовина - це сукупність атомів, атомних частинок чи молекул, що у певному агрегатному стані.
Речовини діляться: прості та складні.
Визначення досить нескладне та легко запам'ятовується.

()
Закономірно виникає питання: чим складна речовина відрізняється від суміші простих та складних речовин?

( )
На малюнку позначено:
А) молекули простої речовини кисень Про 2;
Б) молекули простої речовини водень Н2;
В) суміш простих речовин Про 2 і Н 2;
Г) молекула складної речовини вода Н2О;
Д) суміш молекул простої речовини водень Н2 і складної речовини Н2О.
Суміші утворюються в результаті фізичного впливу, наприклад, змішування залізної тирси і води, а складні речовини - за допомогою хімічного впливу, наприклад, іржа на залозі, викликана взаємодією заліза та води.
Залежно від цього, якими частинками утворені речовини, їх розрізняють молекулярного і немолекулярного будови.
Урок розроблено для УМК Г.Є. Рудзітіса, Ф.Г. Фельдман.
Основна мета даного уроку - це узагальнити та закріпити знання учнів про початкові хімічні поняття; активізація пізнавальної діяльності та підвищення мотивації учнів до вивчення хімії. Розвиток інтересу учнів до хімії та активізація їх пізнавальної діяльності при використанні нестандартних ігрових форм навчальної діяльності. Урок проводиться у формі турніру.
На уроці використовуються ІКТ, необхідність використання комп'ютерної презентації продиктована такими причинами:
- Організація різних видів діяльності учнів.
- Засіб для забезпечення наочності та ущільнення матеріалу.
- Організація самоперевірки без витрат часу уроку.
- Дозволяє економічно витрачати час уроку
Методи: словесні, наочні, використання ІКТ, проблемно-пошукові.

Цілі гри:
- повторення вивченого матеріалу хімії для усунення прогалин та для підготовки до планової контрольної роботи;
- розвиток та зміцнення інтересу до хімії, розширення кругозору учнів, підвищення рівня їхньої культури;
- розвиток комунікаційних здібностей, впевненості та розкутості у спілкуванні;
- виховання відповідального ставлення до колективної діяльності.


Цільова аудиторія: для 8 класу
Дана розробка може використовуватися щодо окислювально-відновних реакцій в 11 класі. Вона містить опис для проведення лабораторної роботи, що демонструє візуальний ефект перетворення сполук хрому та марганцю у різних середовищах.
Також розробка допоможе вчителю пояснити учням, як змінюються ступеня окислення хрому та марганцю залежно від середовища розчину та які сполуки цих елементів утворюються за різних умов. Розробка містить завдання для закріплення матеріалу.


Розробка уроку з хімії у 8 класі. Завданнями даного уроку є:
систематизувати зміст назв та склад складних речовин;
сформувати знання учнів про склад основ, валентності гідроксогрупи, фізичних та хімічних властивостей лугів, їх одержання;
розвивати вміння учнів порівнювати речовини виділяти загальні риси у складі та властивості підстав.
Цілі уроку:
розвиток умінь характеризувати склад підстав за формулами та відрізняти їх від інших складних речовин;
відпрацювання правильності складання та запису рівнянь хімічних реакцій, у тому числі реакції нейтралізації;
формування навичок акуратної роботи з хімічними речовинами згідно з правилами ТБ. Цей урок створено за УМК автора Є.Є.Мінченкова.


Цільова аудиторія: для вчителя
Дана розробка уроку на тему «Періодичний закон та періодична система хімічних елементів Д.І. Менделєєва у світлі теорії будови атома» складена для УМК Гара Н.Н., підручника Хімія-11 (Рудзітіс Г.Є.). Урок розроблено для учнів 11 класу. Методична розробка включає конспект уроку хімії у 11 класі + презентація.
У презентації представлено ілюстрований теоретичний матеріал та контрольно-вимірювальний матеріал для контролю знань та умінь.


План-конспект уроку хімії в 10 класі з УМК Габрієляна О.С. із презентацією з активними посиланнями на відеодосліди.
Цілі уроку:
- вивчити хімічні властивості одноосновних карбонових кислот на прикладі оцтової кислоти;
- згадати взаємний вплив атомів у молекулах карбонових кислот, номенклатуру;
- розвивати логічне мислення, вміння узагальнювати та робити висновки; повторити основні правила техніки безпеки; відпрацьовувати навички поводження з лабораторним обладнанням;
- виховувати культуру мови, вміння слухати та правильно висловлювати свої думки.


Цільова аудиторія: для 10 класу
Думковий експеримент, як одне з найнезвичайніших завдань у підсумковій атестації учнів, викликає суттєві труднощі під час виконання. Умови завдань часто включають опис конкретного хімічного явища, яке супроводжується певними ознаками. Для найбільш повного виконання завдань даного типу від учнів потрібна наявність знань хімічних властивостей речовин, їх назв, тобто розуміння будь-якої хімічної термінології та вміння висловити процеси, що відбуваються у вигляді запису рівнянь реакцій. Для вчителя важливо в ході підготовки до даної форми іспиту зуміти підвести учнів до розуміння ключових слів в описі експерименту.


Цільова аудиторія: для 11 класу
Методична розробка уроку на тему "Кислоти" включає презентацію та конспект уроку. Урок вивчення нового матеріалу на тему, знайомить учнів із класом неорганічних сполук - кислотами, їх загальної формулою, класифікацією, поширенням у природі. Так само учні матимуть можливість познайомитися з основними неорганічними кислотами.
8 клас
Урок 1
«Предмет хімії»
Завдання уроку. Освітні:познайомити учнів із предметом хімії; дати уявлення про хімію як про точну науку, не позбавлену лірики; подати погляду на походження слова “хімія”; показати взаємозв'язок хімії коїться з іншими науками.
Розвиваючі: розвиток пізнавального інтересу до предмета; знайомство учнів із досягненнями сучасної науки, з біографіями великих хіміків.
Виховні: виховання любові до своєї Батьківщини, гордості за досягнення та успіхи нашої країни в галузі науки; виховання дбайливого ставлення до свого здоров'я; виховання шанобливого ставлення до різних точок зору інших людей.
Обладнання та реактиви.портрети Й.Я.Берцеліуса, Д.І.Менделєєва, Р.Бунзена, Ф.А.Кекуле, Н.Н.Бекетова, С.Арреніуса, Р.Вуда, Н.М.Зініна; штативи з пробірками, хімічні стаканчики, щипці тиглів, спиртовка, фарфорова чашка, конічна колба, лучинка; вода, розчин нашатирного спирту, розчин оцтової кислоти, спирт етиловий, бензин, кухонна сіль, цукор, крохмаль, борошно, шматочки льоду, вата, річковий пісок, тирса, парафін, мідний купорос, залізна тирса, мідна стружка, червоний фосфор, сірка , розчини KI, Pb(NO 3 ) 2 , KOH, CuSO 4 , NaOH, FeCl 3 , Na 2 SO 4 , BaCl 2 , HCl, Na 2 CO 3 , CaCl 2 , лакмус, фенолфталеїн, дихромат амонію.
1. Організаційний момент.
Знайомство із класом.
2. Актуалізація знань.
Які асоціації викликає у вас слово хімія?
До якої групи наук належить наука хімія?
Ви вже знаєте, як перекладаються слова: "географія", "геометрія", "біологія", а як перекладається слово "хімія"?
3. Інформація.
Є кілька точок зору походження слова “хімія”.
а) Хмі (єгипетськ.) - "чорна" земля. Давня назва Єгипту, де зародилася наука хімія.
б) Кеме (єгипетськ.) - "чорна" наука. Алхімія як темна, диявольська наука (порівняти з чаклунством - чаклунством, заснованим на дії нечистої сили).
в) Хюма (Древньогрец.) - "Лиття" металів; того ж кореня та грецькехюмос – "сік".
г) Кім (Древньокитайська.) - "Золото". Тоді хімію можна тлумачити як "златоробство".
4. Розминка.
Хімія хоч і складна наука, але багато вам вже відомо з інших наук, з життєвого досвіду. Ми переконаємося в цьому самі: вам пропонують питання з різних тем курсу хімії 8-го, 9-го, 10-го класів. Хто хоче відповісти?
Питання вікторини “Чи така складна хімія?”
Чому ми дуємо на сірник, коли хочемо його згасити?
(У повітрі, що видихається, міститьсяСО 2 .)
Чому бензин, що горить, не можна гасити водою?
(Бензин легший за воду і не змішується з нею.)
Як пронести в долоні 1 літр води, не проливши краплі?
(Заморозити у кригу.)
Що тепліше: три сорочки чи сорочка потрійної товщини?
(Три сорочки.)
В якому морі не можна потонути? Чому?
(У Мертвому морі, воно дуже солоне.)
Що важче: 1 кг заліза чи 1 кг вати?
(Вони рівні.)
З 1 г якого металу можна витягнути дріт завдовжки 2,5 км?
(Із золота.)
Чи можна заповнити повітря лише половину балона?
(Не можна.)
Що означає вираз "як з гусака вода"?
(Пері водоплавних птахів не змочуються водою.)
З'єднання якого металу надають планеті Марс червоного відтінку?
(З'єднання заліза.)
Три однакові свічки, що горять, одночасно накрили трьома банками ємністю 0,4 л, 0,6 л і 1 л. Що при цьому станеться?
(Свічка згасне тим раніше, що менше обсяг банки.)
Так що ж таке – хімія?
Хімія – це наука про речовини, їх властивості, перетворення та явища, що супроводжують ці перетворення
Речовина – це те, із чого складається тіло.
Тіло - Це частина речовини, обмежена в просторі.
Завдання:
- З наведеного переліку визначити речовину або тіло:
цвях, склянку, скло, лійка, залізо, лінійка, крохмаль, Al дріт.
- Вказати речовини, з яких виготовлені тіла:
підкова, вилка, лінійка, пробірка, авторучка
- Про які речовини можна сказати:
А) за звичайних умов – безбарвна рідина без смаку, запаху, tкіп. = 100°С, твердне при 0°С.Чому?
Б) тверда речовина червоного кольору, добре проводить електричний струм, має високу пластичність, дозволяє виготовляти тонкий дріт.
Отже, ми говоримо з вами про властивості речовин
Властивості − це ознаки, за якими одні речовини відрізняються від інших або подібні між собою.
Властивості бувають фізичні та хімічні.
Фізичні – колір, смак, запах, агрегатний стан, електро- та теплопровідність, температура плавлення та кипіння, щільність.
5. Гра “Вгадайте речовину”.
Яка хімія без дослідів? Звичайно, вам самим хочеться "похімічити"! А чи знаєте ви речовини? Чи можете їх відрізнити один від одного?
Давайте перевіримо…
На демонстраційному столі вчителі стоять три лотки з речовинами –
в одному тільки безбарвні прозорі рідини,
в іншому тільки білі тверді речовини,
у третьому – різнокольорові тверді речовини.
Речовина
1-й лоток. У невеликих стаканчиках: вода, розчин нашатирного спирту, розчин оцтової кислоти, спирт етиловий, бензин.
2-й лоток. У маленьких стаканчиках тверді речовини білого кольору: кухонна сіль, цукор, крохмаль, борошно, шматочки льоду, вата.
3-й лоток. У маленьких стаканчиках тверді різнокольорові речовини: річковий пісок, тирсу, парафін, мідний купорос, залізна тирса, мідна стружка, червоний фосфор, сірка.
Нам потрібні три добровольці як експериментатори, які і спробують визначити запропоновані речовини, обов'язково пояснюючи свої дії.
Вчитель попереджає учнів про дотримання правил техніки безпеки під час експерименту.
Учні намагаються визначити речовини.
6. Інформація. Цікаві факти із життя вчених-хіміків.
Демонструються портрети вчених.
Кухарка Берцеліуса.
Жителі одного невеликого містечка, в якому мешкав і працював знаменитий шведський учений Й.Я.Берцеліус, запитали одного разу його куховарку: "Чим, власне, займається твій господар?"
"Не можу сказати точно, - відповіла вона, - Він бере велику колбу з якоюсь рідиною, виливає з неї в маленьку, струшує, виливає ще в меншу, знову струшує і виливає в зовсім маленьку ..."
"А потім?"
"А потім виливає все геть!"
Демонстрація
Для досвіду береться 4 колби різних розмірів. У велику колбу спочатку наливають безбарвний розчин лугу, меншу за розміром колбу заздалегідь змочують розчином фенолфталеїну. Розчин лугу виливають у колбу з фенолфталеїном, розчин забарвлюється малиновий колір. У третю колбу, ще менших розмірів, наливають трохи розчину соляної кислоти більш високої концентрації, ніж розчин лугу, а потім у неї виливають забарвлений розчин лугу. У третій колбі відбувається знебарвлення розчину. А коли всю суміш виливають у зовсім маленьку колбу, в якій знаходиться трохи концентрованого розчину лугу, то розчин знову набуває малинового кольору.
Майстер валізи.
Д.І.Менделєєв любив переплітати книги, клеїти рамки для портретів, виготовляти валізи. Покупки для цих робіт він зазвичай робив у вітальні. Одного разу, вибираючи потрібний товар, він почув за спиною: Хто цей поважний пан? “Таких людей треба знати, – з повагою в голосі відповів прикажчик. – Це майстер валізи Менделєєв!”
Добрий знайомий.
Одного разу до Роберта Бунзена прийшов колега. Вони проговорили години півтори. І гість уже зібрався йти, як раптом Бунзен сказав: “Ви собі уявити не можете, як слабка моя пам'ять. Адже коли я Вас побачив, я подумав, що Ви – Кекуле!” Відвідувач здивовано подивився на нього і вигукнув: "Але я є Кекуле!"
Сванте Арреніус.
Сванте Арреніус дуже рано почав повніти. Він розповідав таку історію, пов'язану з його надмірною вагою. Якось вчені зібралися в центральному готелі Берліна на черговий диспут. Арреніус залишив пальто в гардеробі і відчинив двері, щоб приєднатися до колег, але гардеробник зупинив його словами: "Ви йдете не туди, пане, корпорація м'ясників засідає поруч!"
На роботі.
Американський фізик Роберт Вуд розпочинав свою кар'єру служителем у лабораторії. Якось його шеф зайшов у приміщення, наповнене гуркотом і брязкотом насосів та обладнання, і застав там Вуда, захопленого читанням карного роману. Обуренню шефа не було меж.
- Містер Вуд! – вигукнув він, розпалюючись від гніву. – Ви… Ви дозволяєте читати детектив?!
– Ради бога, вибачте! – зніяковів Вуд. – Але за такого шуму поезія просто не сприймається!
Богатирські забави професора Зініна.
Чи застосовувалося рукоприкладство до студентів у Росії? Грубого насильства не було, але потиличниками викладачі, хоч і рідко, користувалися. Відомий академік Н.Н.Зінін не тільки лаяв недбайливих студентів, а й лупцював їх. Ніхто цього ображався, т.к. дозволялося давати здачі академіку. Але мисливців вжити заходів у відповідь не було. Зінін мав велику фізичну силу і міг так стиснути противника в обіймах, що той довго не міг прийти до тями.
7. Чудеса своїми руками.
На столах учнів штативи із двома пробірками.
Ви самі – чудові експериментатори, за допомогою простих прийомів ви можете творити чудеса. Ваше завдання – змішати вміст пробірок один з одним.
Вчитель пояснює учням правила техніки безпеки під час виконання експерименту.
Розчини підібрані таким чином, що в кожному випадку випадають опади різних кольорів, або виділяється газ, або змінюється колір.
Учні виконують експеримент, спостерігають зміни, що відбуваються. (Взяті, наприклад, розчини йодиду калію та нітрату свинцю(II); гідроксиду калію та сульфату міді(II); гідроксиду натрію та хлориду заліза(III); сульфату натрію та хлориду барію; лакмусу та соляної кислоти, лакмусу та гідроксиду натрію; оцту; кислоти та карбонату натрію та ін.)
8. Давайте пограємо…
Гра "Вгадай - що?"
П е р в о е ре щество
1) Цю речовину за старих часів називали володарем життя і смерті. Його приносили в жертву богам, інколи ж поклонялися як божеству.
(5 балів.)
2) Воно служило мірилом багатства, могутності, стійкості, влади, вважалося хранителем молодості та краси.
(4 бали.)
3) За повір'ями, воно має здатність допомагати людині у всіх її справах, рятувати від бід і напастей.
(3 бали.)
4) "З води народиться, а води боїться".
(2 бали.)
5) Широко застосовується у побуті, у кулінарії, у шкіряній справі, у текстильній промисловості та інших.
(1 бал.)
(Відповідь. Кухонна сіль.)
В т о р о е ще с т в о
1) Стародавні єгиптяни називали його "вааепере", що означає "народжене на небі".
(5 балів.)
2) Стародавні копти називали його "каменем неба".
(4 бали.)
3) Вироби з нього цінувалися дорожче за золото. Тільки дуже багаті люди могли мати виготовлені з нього кільця та брошки.
(3 бали.)
4) Алхіміки вважали його настільки неблагородним металом, що займатися ним не варто.
(2 бали.)
5) На його ім'я названо століття. Це м'який пластичний метал.
(1 бал.)
(Відповідь. Залізо.)
9. "Чи знаєте ви, що ..."
Вчитель. Зараз ми з вами дізнаємося про досягнення сучасної науки, про цікаві відкриття в галузі хімії та суміжних наук.
Нано (від грец. nanos – карлик) – мільярдна частка чогось. Область науки, що займається вивченням властивостей об'єктів розміром 10–9 м. Нанотехнології маніпулюють окремими частинками розміром від 1 до 100 нм, а також розробляють пристрої таких розмірів. Зараз створено порошки та суспензії, що покращують роботу двигунів та механізмів. Покриття з матеріалів, виконаних за допомогою нанотехнологій, запобігають появі іржі, допомагають матеріалу самоочищатися або не змочуватись водою. Перші нанороботи здатні подорожувати організмом тварин. Водень можна безпечно зберігати за допомогою нанотрубок. У майбутньому можливе конструювання будь-яких молекул, створення надміцних матеріалів. У медицині планується створення ліків спрямованої дії, що проникають у уражену тканину чи пухлину; використання нанороботів для діагностики та лікування майже всіх хвороб, вирощування тканин та органів. В електроніці – створення надмініатюрних електронних пристроїв, гнучких дисплеїв, електронного паперу, нових типів двигунів і паливних елементів.
Багато гляціологів вважають, що товщина полярних льодовикових покривів скорочується неослабними темпами. За 5 років обсяг льодів, що сходять в Атлантику щорічно, зріс майже вдвічі, що рівносильно підйому рівня Світового океану на 0,5 мм на рік. Антарктида у період з 2002 по 2005 роки. втрачала щорічно в середньому 152 км. 3 льоду. Рівень океану до 2100 може піднятися на 4-6 м від сучасних позначок.
Грецькі та латинські написи, зроблені на каменях 2000 років тому, не піддаються прочитанню через ерозію, що зруйнувала їх. Для відновлення написів вчені застосували метод флюоресценції: коли рентгенівські промені бомбардують поверхню, атоми приходять у збуджений стан, а потім, повертаючись у стан спокою, випромінюють видиме світло. Це дозволяє визначити сліди свинцю чи заліза, залишені різцем античного автора.
Хіміки Росії вигадали, як переробляти пластмасові пляшки, а також синтезували новий наповнювач для гум та полімерів. Водневе паливо дасть замість вихлопних газів чисту воду.
У США розроблено прозоре полімерне покриття для стін, якого нічого не прилипає. Це речовина типу тефлону. На такому покритті неможливо писати чи малювати фарбами, крейдою чи фломастером. Покриття можна використовувати для захисту днищ морських суден від обростання та фюзеляжів літаків від зледеніння.
10. Цікаві демонстраційні досліди.
Вчитель. Сьогодні відбулося ваше перше знайомство із хімією. Звичайно, ви чекаєте на щось незвичайне, чудове. Спробую перетворитись на мага і показати вам чудеса хімії.
Вчитель демонструє досвід.
"Дим без вогню".
Два стаканчики змочують концентрованими розчинами аміаку та соляної кислоти, а потім їх підносять один до одного. Спостерігають дим без вогню.
“З однієї склянки – газована вода, малиновий сік та молоко”.
У три однакові хімічні склянки наливають безбарвні прозорі розчини соляної кислоти, хлориду кальцію та фенолфталеїну. У порцеляновий кухоль наливають розчин карбонату натрію. Потім з кухля наливають карбонат натрію по черзі в кожну з трьох склянок. У першому з них бурхливо виділяється газ (“газування”), у другому – з'являється осад білого кольору (“молоко”), а третьому – розчин стає малиновим через зміну забарвлення індикатора в лужному розчині (“малиновий сік”).
"Негорюча хустка".
Носову хустку змочують у воді, а потім в етиловому спирті. За допомогою тигельних щипців його підносять до палаючої спиртівки і підпалюють. Незважаючи на велике полум'я, хустка в результаті залишається цілою, т.к. спирт спалахує і згоряє раніше, ніж загориться волога тканина.
"Вулкан на столі".
На горло конічної колби ставлять порцелянову чашку. Під колбу кладуть великий аркуш паперу. У чашку насипають дихромат амонію, у центрі трохи змочують спиртом. Запалюють “вулкан” палаючою лучинкою. Реакція протікає бурхливо, складається враження вулкана, що вивергається, з кратера якого виливаються розпечені маси.
11. Підбиття підсумків уроку.
Д/з: §-1стор. 13 №3,4
 Історія стародавнього китаю Доповідь, повідомлення Де жили давні люди китаю
Історія стародавнього китаю Доповідь, повідомлення Де жили давні люди китаю Уроки хімії Йодом змочимо ми рясно, щоб було все стерильно
Уроки хімії Йодом змочимо ми рясно, щоб було все стерильно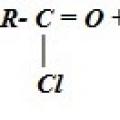 Хімічні властивості. Отримання. Одержання карбонових кислот Отримання карбонових кислот окисненням вуглеводнів
Хімічні властивості. Отримання. Одержання карбонових кислот Отримання карбонових кислот окисненням вуглеводнів