Näide mittekonkureerivast ensüümi inhibeerimisest. Mittekonkureeriv pärssimine
Inhibeerimine
- See on ensüümi aktiivsuse pärssimine. Sel juhul ensüümi denaturatsiooni ei toimu.
Inhibiitor - aine, mis põhjustab spetsiifiline vähenenud aktiivsus ensüüm. Anorgaanilised happed ja raskmetallid ei ole inhibiitorid, vaid on inaktivaatorid, kuna need vähendavad mis tahes ensüümide aktiivsust, st. tegutsema mittespetsiifiline Samuti ei klassifitseerita denatureerivaid aineid inhibiitoriteks.
Inhibiitorid: ioonid või väikesed molekulid, mis moodustavad osa ensüümi regulatsioonisüsteemist, samuti farmakoloogilised ravimid.
Vastavalt ensüümi inhibiitoriga seondumise tugevusele toimub inhibeerimine pööratav Ja pöördumatu.
ensüümi aktiivse saidi inhibiitori suhtes jaguneb inhibeerimine järgmisteks osadeks konkurentsivõimeline Ja mittekonkurentsivõimeline.
Inhibeerimise tüübid
1. Pööratav 2. Pöördumatu
A. KONKURENTSIVÕIME A. KONKREETSED
B. MITTEKONKURENTS B. MITTESPEKTIIVNE
Pöörduv inhibeerimine. Enamik inhibiitoreid toimivad pöörduvalt, moodustades mittekovalentsed sidemed ensüümiga ja teatud tingimustel dissotsieeruvad ensüümi aktiivsuse taastamisega.
Konkurentsivõimeline pärssimine.Inhibiitor on sarnane ensüümi substraadiga oma struktuuris ja konkureerib substraadiga aktiivse keskuse pärast ( asub ensüümi aktiivsel saidil), mis viib substraadi seondumise vähenemiseni ensüümiga ja katalüüsi katkemiseni. See on konkureeriva pärssimise eripära - võime suurendada või vähendada inhibeerimist substraadi kontsentratsiooni muutmise kaudu.
Konkureeriva inhibeerimise puhul kehtivad järgmised võrrandid:
E + S ⇔ ES → E + P,
1. Konkurentsivõimeline suhtlus etanool Ja metanool aktiivse keskuse jaoks alkoholdehüdrogenaas.
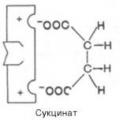
2. Inhibeerimine suktsinaatdehüdrogenaas maloonhape, mille struktuur on sarnane selle ensüümi substraadi - merevaikhappe (suktsinaadi) - struktuuriga.

Suktsinaat + FAD ----------- Fumaraat + FADN 2
3. Konkureerivate inhibiitorite hulka kuuluvad ka antimetaboliidid või pseudosubstraadid, näiteks antibakteriaalsed ained sulfoonamiidid, mis on struktuurilt sarnane P-aminobensoehape, foolhappe komponent. Sulfoonamiididega ravimisel häirib bakterirakk konkureerivalt nende kasutamist P-aminobensoehape sünteesiks foolhape, mis põhjustab ravitoimet.

Sulfoonamiidide ja vitamiini B9 komponendi para-aminobensoehappe struktuuri sarnasus

Substraadi erinevate kontsentratsioonide mõju ensüümide 1 ja katalüüsitud reaktsiooni kiirusele2 (inhibiitori juuresolekul): a) hüperboolne sõltuvusValates [S], b) otsesõltuvus pöördkoordinaatides 1/Valates 1/[S] - Lineweaver-Burk.
Konkureerivad inhibiitorid vähendavad keemilise reaktsiooni kiirust. Konkureeriv inhibiitor suurendab antud substraadi K m (vähendab substraadi afiinsust ensüümi suhtes). See tähendab, et konkureeriva inhibiitori juuresolekul vajalik kõrge substraadi kontsentratsioon saavutada 1/2 V max. Substraadi ja inhibiitori kontsentratsioonide suhte suurendamine vähendab inhibeerimise astet. Oluliselt kõrgemate substraadikontsentratsioonide korral kaob inhibeerimine täielikult, sest kõigi ensüümmolekulide aktiivsed keskused asuvad valdavalt substraadiga kompleksis.
Mittekonkureeriv pärssimine.Inhibiitorei oma struktuurne sarnasus substraadiga jakinnitub muusse kohta kui aktiivne sait, ja teises kohas molekul samaaegselt substraadiga. Moodustub kolmekordne kompleks: substraat - ensüüm - inhibiitor. See toob kaasa aktiivse saidi deformatsiooni ja katalüütilise aktiivsuse. Näiteks, vesiniktsüaniidhape (tsüaniidid) seondub hingamisahela ensüümide heemi rauaga ja blokeerib rakkude hingamist.

Mittekonkureeriva inhibeerimise kineetiline sõltuvus: mida iseloomustab ensümaatilise reaktsiooni V max vähenemine ja substraadi afiinsuse vähenemine ensüümi suhtes, s.o. suurendades K m.

Mittekonkureeriv inhibeerimine topeltpöördkoordinaatides erinevatel inhibiitori kontsentratsioonidel (1 - [I]=0; 2 - [I]>0; 3 - [I]> [I]2).
Mittekonkureeriva inhibeerimise korral Michaelise konstant ei muutu ja maksimaalne reaktsioonikiirus väheneb (1 + [ I]/K i) üks kord. Seetõttu lõikub kahekordsetes vastastikustes koordinaatides erinevale inhibiitori kontsentratsioonile vastav sirgjoonte perekond abstsisstelje ühes punktis Pöördumatut inhibeerimist täheldatakse stabiilsete kovalentsete sidemete tekkimisel inhibiitori molekuli ja ensüümi vahel. Kõige sagedamini muudetakse ensüümi aktiivset keskust, mistõttu ei saa ensüüm täita katalüütilist funktsiooni.
Pöördumatute inhibiitorite hulka kuuluvad raskemetallide ioonid, nagu elavhõbe (Hg 2+), hõbe (Ag +) ja arseen (As 3+), mis madalas kontsentratsioonis blokeerivad aktiivse tsentri sulfhüdrüülrühmi. Sel juhul ei saa substraat läbida keemilist transformatsiooni (joonis 2-26). Reaktivaatorite juuresolekul taastatakse ensümaatiline funktsioon. Raskmetallide ioonid põhjustavad suurtes kontsentratsioonides ensüümi valgumolekuli denaturatsiooni, s.t. viia ensüümi täieliku inaktiveerimiseni.
Kõik organismis toimuvad biokeemilised reaktsioonid alluvad spetsiifilisele kontrollile, mis viiakse läbi reguleerivaid ensüüme aktiveeriva või inhibeeriva toime kaudu. Viimased on tavaliselt metaboolsete transformatsioonide ahelate alguses ja kas käivitavad mitmeetapilise protsessi või pärsivad seda. Mõned üksikud reaktsioonid on samuti reguleeritavad. Konkurentsivõimeline inhibeerimine on üks peamisi mehhanisme ensüümide katalüütilise aktiivsuse kontrollimiseks.
Ensümaatilise katalüüsi mehhanism põhineb ensüümi aktiivse tsentri seondumisel substraadi molekuliga (ES-kompleks), mille tulemuseks on keemiline reaktsioon koos produkti moodustumise ja vabanemisega (E+S = ES = EP = E+ P).
Ensüümi inhibeerimine on katalüüsiprotsessi kiiruse vähenemine või täielik peatamine. Kitsamas tähenduses tähendab see termin aktiivtsentri afiinsuse vähenemist substraadi suhtes, mis saavutatakse ensüümmolekulide sidumisel inhibiitorainetega. Viimased võivad toimida mitmel viisil, mille alusel jagunevad nad mitmeks tüübiks, mis vastavad samadele inhibeerimismehhanismidele.
Peamised inhibeerimise tüübid
Sõltuvalt protsessi olemusest võib inhibeerimist olla kahte tüüpi:
- Pöördumatu - põhjustab püsivaid muutusi ensüümi molekulis, jättes selle funktsionaalsest aktiivsusest ilma (viimast ei saa taastada). See võib olla nii spetsiifiline kui ka mittespetsiifiline. Inhibiitor seondub kovalentse interaktsiooni kaudu tihedalt ensüümiga.
- Pöörduv on ensüümide negatiivse regulatsiooni peamine tüüp. See viiakse läbi tänu inhibiitori pöörduvale spetsiifilisele kinnitumisele ensüümvalgu külge nõrkade mittekovalentsete sidemete kaudu, mida saab Michaelis-Menteni võrrandi järgi kineetiliselt kirjeldada (erandiks on allosteeriline regulatsioon).
Pöörduvat ensüümi inhibeerimist on kaks peamist tüüpi: konkureeriv (substraadi kontsentratsiooni suurendamisega saab seda nõrgendada) ja mittekonkureeriv. Viimasel juhul väheneb maksimaalne võimalik katalüüsi kiirus.
Peamine erinevus konkureeriva ja mittekonkureeriva inhibeerimise vahel on see, kus reguleeriv aine seondub ensüümiga. Esimesel juhul seondub inhibiitor otse aktiivse saidiga ja teisel juhul ensüümi teise osaga või ensüümi-substraadi kompleksiga.
On olemas ka segatüüpi inhibeerimine, mille puhul inhibiitoriga seondumine ei takista ES teket, vaid aeglustab katalüüsi. Sel juhul on regulaatoraine osa kahe- või kolmekomponentsetest kompleksidest (EI ja EIS). Mittekonkureerivas tüübis seondub ensüüm ainult ES-ga.
Pöörduva konkureeriva ensüümi inhibeerimise tunnused
Inhibeerimise konkureeriv mehhanism põhineb regulatoorse aine struktuursel sarnasusel substraadiga. Selle tulemusena moodustub aktiivse tsentri kompleks inhibiitoriga, mis on tavapäraselt tähistatud kui EI.
Pöörduval konkureerival inhibeerimisel on järgmised omadused:
- seondumine inhibiitoriga toimub aktiivses kohas;
- ensüümi molekuli inaktiveerimine on pöörduv;
- inhibeerivat toimet saab vähendada substraadi kontsentratsiooni suurendamisega;
- inhibiitor ei mõjuta ensümaatilise katalüüsi maksimaalset kiirust;
- EI kompleks võib laguneda, mida iseloomustab vastav dissotsiatsioonikonstant.
Seda tüüpi regulatsiooni puhul näib, et inhibiitor ja substraat konkureerivad (konkureerivad) üksteisega aktiivses keskuses oleva koha nimel, kust tuleb protsessi nimi.

Selle tulemusena võib konkureerivat inhibeerimist määratleda kui ensümaatilise katalüüsi inhibeerimise pöörduvat protsessi, mis põhineb aktiivse tsentri spetsiifilisel afiinsusel inhibiitoraine suhtes.
Toimemehhanism
Inhibiitori seondumine aktiivse saidiga takistab katalüüsiks vajaliku ensüümi-substraadi kompleksi moodustumist. Selle tulemusena muutub ensüümi molekul mitteaktiivseks. Kuid katalüütiline kese võib kokku puutuda mitte ainult inhibiitoriga, vaid ka substraadiga. Konkreetse kompleksi moodustumise tõenäosus sõltub kontsentratsiooni suhtest. Kui substraadi molekule on oluliselt rohkem, reageerib ensüüm nendega sagedamini kui inhibiitoriga.

Mõju keemilise reaktsiooni kiirusele
Katalüüsi inhibeerimise aste konkureeriva inhibeerimise ajal määratakse ensüümi kogusega, mille EI kompleksid moodustavad. Sel juhul on võimalik substraadi kontsentratsiooni suurendada sellisel määral, et inhibiitori roll nihkub välja ja katalüüsi kiirus saavutab maksimaalse võimaliku väärtuse, mis vastab Michaelise järgi V max väärtusele. - Menteni võrrand.
Seda nähtust seletatakse inhibiitori tugeva lahjendamisega. Selle tulemusena väheneb ensüümi molekulide sellega seondumise tõenäosus nullini ja aktiivsed keskused reageerivad ainult substraadiga.
Konkureeriva inhibiitori osalusel toimuva ensümaatilise reaktsiooni kineetilised sõltuvused
Konkurentsivõimeline inhibeerimine suurendab Michaelise konstanti (K m), mis on võrdne substraadi kontsentratsiooniga, mis on vajalik ½ maksimaalse katalüüsi kiiruse saavutamiseks reaktsiooni alguses. Hüpoteetiliselt substraadiga kontakteeruva ensüümi kogus jääb konstantseks ja tegelikult moodustunud ES komplekside arv sõltub ainult viimaste kontsentratsioonist (EI kompleksid ei ole konstantsed ja substraadi poolt tõrjutavad).
Ensüümide konkureerivat inhibeerimist saab kergesti määrata kineetilise sõltuvuse graafikutest, mis on kujutatud erinevate substraadikontsentratsioonide jaoks. Sel juhul K m väärtus muutub, kuid V max jääb konstantseks.

Mittekonkureeriva inhibeerimisega on vastupidine: inhibiitor seondub väljaspool aktiivset kohta ja substraadi olemasolu ei saa seda kuidagi mõjutada. Selle tulemusena "lülituvad" mõned ensüümi molekulid katalüüsist välja ja maksimaalne võimalik kiirus väheneb. Sellegipoolest võivad aktiivsed ensüümi molekulid substraadiga vabalt seonduda nii viimase madalal kui ka kõrgel kontsentratsioonil. Seetõttu jääb Michaelise konstant konstantseks.

Konkurentsi inhibeerimise graafikud topeltpöördkoordinaatide süsteemis kujutavad mitut sirget, mis ristuvad ordinaatteljega punktis 1/V max. Iga sirge joon vastab teatud substraadi kontsentratsioonile. Erinevad lõikepunktid x-teljega (1/[S]) näitavad Michaelise konstandi muutust.
Konkureeriva inhibiitori toime malonaadi näitel
Konkureeriva inhibeerimise tüüpiline näide on suktsinaatdehüdroginaasi aktiivsuse vähendamise protsess, ensüüm, mis katalüüsib merevaikhappe (suktsinaadi) oksüdeerumist fumaarhappeks. Malonaat, mis on struktuurilt sarnane suktsinaadiga, toimib siin inhibiitorina.

Inhibiitori lisamine söötmele põhjustab malonaadi komplekside moodustumist suktsinaatdehüdrogenaasiga. Selline side ei kahjusta aktiivset keskust, vaid blokeerib selle ligipääsu merevaikhappele. Suktsinaadi kontsentratsiooni suurendamine vähendab inhibeerivat toimet.

Kasutamine meditsiinis
Konkurentsi inhibeerimise mehhanism on paljude ravimite toime aluseks, mis on mõnede metaboolsete radade substraatide struktuursed analoogid, mille inhibeerimine on vajalik osa haiguste ravist.
Näiteks närviimpulsside juhtivuse parandamiseks lihasdüstroofia korral on vaja tõsta atsetüülkoliini taset. See saavutatakse seda hüdrolüüsiva atsetüülkoliinesteraasi aktiivsuse pärssimisega. Kvaternaarsed ammooniumialused, mis on ravimite osad (proresiin, endrofoonium jne), toimivad inhibiitoritena.
Erirühma kuuluvad antimetaboliidid, millel on lisaks inhibeerivale toimele pseudosubstraadi omadused. Sel juhul põhjustab EI kompleksi moodustumine bioloogiliselt inertse anomaalse produkti moodustumist. Antimetaboliidid hõlmavad sulfoonamiide (kasutatakse bakteriaalsete infektsioonide raviks), nukleotiidi analooge (kasutatakse vähirakkude kasvu peatamiseks) jne.
Konkurentsitõkestamine: määratlus, funktsioonid ja näited – kõik saidile reisimise kohta
Ensüümide aktiivsuse pärssimise uurimine on üks viise nende toimemehhanismi dešifreerimiseks. Viimase probleemi lahenduseks on ensüümi toime spetsiifilisuse uurimine. See omakorda nõuab kineetiliste parameetrite õiget mõõtmist uuritava substraadi analoogi juuresolekul. Mõelgem kindlaks määramise viisidele suhte olemus substraadid, nende analoogid ja ensümaatilise aktiivsuse inhibiitorid, arvutades välja mitmed kineetilised parameetrid.
Veelgi enam, kui kompleksi dissotsiatsioonikonstant K s = K m on võrdne:

Inhibiitorid Ensüümid võib jagada kahte põhirühma: pööratav Ja pöördumatu. Pärast esimest tüüpi inhibiitori eemaldamist taastatakse ensüümi aktiivsus; teisel juhul ei saa inhibiitorit eemaldada või ensüümi aktiivsus ei taastu isegi pärast inhibiitori eemaldamist. Pöördumatu inhibeerimine on maksimaalne, kui kogu ensüüm on seotud inhibiitoriga. Pöörduv inhibeerimine saavutab tasakaaluseisundi, mille asukoha määrab inhibeerimise konstant, mis iseloomustab ensüümi afiinsust inhibiitori suhtes. Pöörduva inhibeerimise skeem on näidatud allpool:
Konkureeriva inhibeerimise korral seonduvad substraat ja inhibiitor ensüümi sama aktiivse saidiga. Inhibiitori juuresolekul väheneb ensüümi afiinsus substraadi suhtes. Väärtus ei muutu, kuna "küllastava" kontsentratsiooni korral tõrjub substraat inhibiitori kompleksist välja ensüümiga.
Kell mittekonkureeriv pärssimine substraat ja inhibiitor seonduvad ensüümi erinevate saitidega. Sel juhul K ha väärtus ei muutu ja V max väärtus väheneb.
Võimalikud on ka vahepealsed või alternatiivsed juhud, näiteks kui inhibiitor ei seondu ensüümiga, vaid ensüümi-substraadi kompleksiga, nagu juhtus. mittekonkurentsivõimeline inhibeerimine, mille käigus muutuvad mõlemad kineetilised parameetrid.
Inhibeerimise tüübi määramiseks kasutatakse tavaliselt Lineweaver-Burki graafikut, mis saadakse antud substraadi jaoks inhibiitori puudumisel ja juuresolekul.
Konkureeriva inhibeerimise korral, kui määratakse Kt väärtus inhibiitori juuresolekul, saab inhibeerimiskonstandi arvutada järgmise valemi abil:
Mittekonkureeriva inhibeerimise korral saab V muutunud väärtuse määramisel K arvutada järgmise valemi abil:

Kõik rakus toimuvad biokeemilised protsessid on omavahel seotud ja üksteisest sõltuvad, kuid osa neist täidab eelkõige rakulise materjali ülesehitamise funktsiooni ja osa annab nendeks “ehitustöödeks” energiaallikaid. Seetõttu on tavaks jagada biokeemilised protsessid kahte põhitüüpi: assimilatsioon, helistas anabolism, sealhulgas madala molekulmassiga prekursorite süntees ja nendest biopolümeermolekulide konstrueerimine, ja dissimilatsioon, helistas katabolism, mis seisneb energiaallika pakkumises, "energiaajamis", mis juhib anabolismi.
Vaatleme rakus toimuvate energia muundamise protsesside põhimehhanisme, s.o. kataboolsete protsesside mehhanismid.
Ensüümide aktiivsust saab reguleerida ensüümide interaktsiooni kaudu erinevate bioloogiliste komponentide või võõrühenditega, mida nimetatakse ensüümi regulaatorid. Need võivad ensümaatilist reaktsiooni kas kiirendada või aeglustada.
Aktivaatorid– need on ained, mis kiirendavad ensümaatilisi reaktsioone.
Liigid aktivaatorid:
1. Ained, mis mõjutavad aktiivse saidi piirkonda. Need sisaldavad metalliioonid(Na+, K+, Fe2+, Co2+, Cu2+, Ca2+, Zn2+, Mg2+, Mn2+ jne). Mõnel juhul toimivad metalliioonid ensüümi kofaktorina. Muudel juhtudel soodustavad need substraadi kinnitumist ensüümi aktiivse saidiga. Metalliioonid osutuvad aktivaatoriteks ainult nende puuduse korral kehas.
2. Allosteerilised efektorid, mis seonduvad apoensüümi allosteerilise (regulatiivse) saidiga. See seondumine põhjustab valgu molekulis konformatsioonilisi muutusi, mis toob kaasa muutuse aktiivse saidi struktuuris, mis mõjutab substraadi seondumist ja konversiooni aktiivses kohas. Sel juhul ensüümi aktiivsus kas suureneb (see allosteerilised aktivaatorid) või väheneb (see on allosteerilised inhibiitorid). Ensüümide allosteerilisteks efektoriteks on enamasti erinevad metaboliidid, aga ka hormoonid, metalliioonid, nukleosiidid - ATP, ADP, AMP.
3. Ained, mis põhjustavad modifikatsioone, mis ei mõjuta ensüümi aktiivset saiti. Selliste modifikatsioonide jaoks on mitu võimalust:
- aktiveerimine, kinnitades ensüümi molekulile spetsiifilise modifitseeriva rühma. Näide: tegevuse reguleerimine lipaasid.
passiivne ATP ADP aktiivne O
proteiinkinaas║
─CH2OH ─CH2─O─P─OH
fosfataas│
Sel juhul kinnitub fosfaatrühm ensüümi valguosas paiknevate aminohapete hüdroksüülrühmade külge. Negatiivselt laetud fosfaatrühmad võivad lõhkuda nõrgad vesinik- ja ioonsidemed ensüümvalgu tertsiaarstruktuuris ning mõjutada selle aktiivse tsentri konformatsioonilist seisundit. Sõltuvalt ensüümi olemusest võib fosforüülimine seda aktiveerida või vastupidi, inaktiveerida. Fosfaatrühma lisamise reaktsioone katalüüsivad ensüümid proteiinkinaasid ja jagamised – fosfataasid. Nende ensüümide aktiivsust omakorda kontrollib hormonaalsüsteem.
- aktiveerimine inaktiivse prekursori - proensüümi üleminekul aktiivseks ensüümiks osalise proteolüüsi tõttu.
Mõned ensüümid sünteesitakse rakus algselt inaktiivsed ja pärast rakust sekretsiooni muutuvad aktiivseks. Mitteaktiivseid eelkäijaid nimetatakse proensüümid (sümogeenid). Aktivaatori mõjul toimub proensüümi osaline hüdrolüüs koos inaktiivse peptiidi lõhustamisega sellest, mille tulemusena avaneb aktiivne keskus. See aktiveerib seedetraktis ensüüme, mis seedivad toiduvalke. Näiteks ensüüm pepsinogeeni, sünteesitakse mao rakkudes, seejärel muutub mao luumenis soolhappe mõjul aktiivseks pepsiin eemaldades polüpeptiidahela inaktiivse osa:
mitteaktiivne HCl aktiivne
pepsinogeeni pepsiin + peptiid
(proensüüm)
- aktivaator põhjustab kvaternaarse struktuuriga ensüümi subühikute dissotsiatsiooni(ühe ensüümi subühiku lõhustamine).
Inhibiitoridon ained, mis põhjustavad ensüümi aktiivsuse vähenemist. Tuleb teha vahet ensüümi inaktiveerimisel ja inhibeerimisel. Ainuüksi fakt ensümaatilise reaktsiooni pärssimisest aine juuresolekul ei tähenda, et see aine on inhibiitor. Kõik denatureerivad ained põhjustavad ensüümi inaktiveerimist ja ensümaatilise reaktsiooni pärssimist. Inhibiitorid, erinevalt denatureerivatest ainetest, toimivad madalates kontsentratsioonides ja põhjustavad spetsiifilist ensümaatilise aktiivsuse vähenemist.
Ensüümiga seondumise tugevuse alusel jagunevad inhibiitorid pööratav Ja pöördumatu. Pöördumatud inhibiitorid seostuvad ensüümiga tihedalt, samas kui ensüümi-pöörduva inhibiitori kompleks on nõrk. Kui ensüümi lahust pöörduva inhibiitoriga oluliselt lahjendada, laguneb nende kompleks ja ensüümi aktiivsus taastub.
Toimemehhanismi alusel jagatakse inhibiitorid konkureerivateks ja mittekonkureerivateks. Konkureerivad inhibiitorid neil on struktuurne sarnasus substraadi molekuliga, mis võimaldab neil ensüümi aktiivses keskuses substraadi asemele asuda:
E + S + I → EI + S
Integreerituna substraadi asemel aktiivsesse keskusesse, takistab selline inhibiitor ensümaatilise reaktsiooni toimumist. See tähendab, et substraat konkureerib inhibiitoriga aktiivse saidi pärast. Rohkemate molekulidega ühend seondub aktiivse keskusega. Konkureeriva inhibeerimise saab eemaldada substraadi kontsentratsiooni suurendamisega.
Paljude farmakoloogiliste ravimite (näiteks sulfoonamiidid), insektitsiidide ja fosfororgaaniliste keemiliste võitlusainete (sariin, somaan) toime põhineb konkureeriva inhibeerimise põhimõttel.
Mittekonkureerivad inhibiitorid neil puudub struktuurne sarnasus substraatidega. Nad kas seonduvad ensüümi aktiivse saidi katalüütiliste rühmadega või, seondudes ensüümiga väljaspool aktiivsaiti, muudavad nad aktiivse saidi konformatsiooni nii, et see takistab substraadi muundumist. Kuna mittekonkureeriv inhibiitor ei mõjuta substraadi seondumist, siis erinevalt konkureerivast inhibeerimisest täheldatakse kolmekomponendilise kompleksi moodustumist:
E + S + I → ESI
Mittekonkureerivate inhibiitorite hulka kuuluvad raskemetallide ioonid: elavhõbe, plii, kaadmium, arseen. Nad blokeerivad SH-rühmi, mis sisalduvad ensüümi katalüütilises kohas. Mittekonkureeriva inhibiitori toimet on võimatu eemaldada liigse substraadiga, nagu konkureeriva inhibeerimise korral, kuid ainult ainetega, mis seovad inhibiitorit ( reaktivaatorid). Raskmetallid toimivad inhibiitoritena ainult väikestes kontsentratsioonides, suurtes kontsentratsioonides aga denatureerivad ained.
Kõige olulisemad mittekonkureerivad inhibiitorid on elusrakus moodustunud vaheproduktid, mis võivad pöörduvalt seonduda ensüümi allosteeriliste saitidega. allosteerilised inhibiitorid. Neil on ainevahetuses võtmepositsioon, kuna nad reageerivad delikaatselt ainevahetuse muutustele ja reguleerivad ainete liikumist läbi terve ensüümide süsteemi. Näiteks allosteeriline regulatsioon avaldub ahela esimese ensüümi inhibeerimises lõpp-produkti poolt. See regulatsioon sarnaneb regulatsiooniga tagasiside mehhanismiga ja võimaldab teil kontrollida lõpptoote saagist, mille akumuleerumisel ahela esimese ensüümi töö peatub:
A → B → C → D
E1, E2, E3 – ensüümid; A, B, C, D - metaboliidid
1. Aktivaatorid - ained, mis suurendavad ensümaatiliste reaktsioonide kiirust ja suurendavad ensüümide aktiivsust. Need on orgaanilised ja anorgaanilised.
Orgaanilised aktivaatorid: sapphapped (aktiveerivad pankreast), enterokinaas (aktiveerivad trüpsinogeeni), glutatioon, tsüsteiin, C-vitamiin (suurendavad oksidoreduktaaside aktiivsust).
Anorgaanilise iseloomuga aktivaatorid: näiteks HCl aktiveerib pepsinogeeni, metalliioonid (Na, Cl, K, Mg, Mn, Zn) aktiveerivad paljusid ensüüme. Metalliioonid: a) aitavad kaasa ensüümi-substraadi kompleksi moodustumisele; b) olla elektronide doonorid ja aktseptorid; c) osaleda ensüümide aktiivse keskuse moodustamises (Zn karbanhüdraasi koostises, Fe tsütokroomide koostises, katalaas, peroksidaas); d) toimivad allosteeriliste regulaatoritena.
2. Inhibiitorid on ained, mis vähendavad ensüümide aktiivsust ja aeglustavad keemilisi reaktsioone. Eristatakse pöörduvat ja pöördumatut pärssimist:
Kui inhibiitor seostub ensüümi molekuliga nõrkade sidemetega (E + I ↔ EI), siis on selline inhibiitor kergesti eemaldatav ja ensüümi aktiivsus taastub;
Kui inhibiitor seondub ensüümi molekuliga tugevate kovalentsete sidemetega (E + I → EI), toimub ensüümi aktiivsuse pöördumatu allasurumine
Pöördumatu inhibeerimine toimub ensüümvalkude denatureerimisel kontsentreeritud hapete ja leeliste, raskmetallide soolade ja ultraviolettkiirguse mõjul. Mõned inhibiitorid moodustavad tugevad mitteeralduvad sidemed funktsionaalrühmadega ensüümide aktiivsetes kohtades. Näiteks tsüaniid seondub rauaga hemoproteiini ensüümides. Fosfororgaanilised mürgid (tabun, sariin, V gaasid) moodustavad tugevad sidemed seriini ja treoniini jääkidega, mis on osa paljudest ensüümidest. Pöörduv inhibeerimine jaguneb konkureerivaks ja mittekonkureerivaks. Konkurentsi inhibeerimist põhjustavad ained, mis on struktuurilt sarnased substraadiga ja interakteeruvad ensüümi aktiivse saidiga. Näiteks maloonhape on suktsinaatdehüdrogenaasi konkureeriv inhibiitor, kuna see sarnaneb merevaikhappega (samuti sisaldab 2 karboksüülrühma). Seetõttu seondub maloonhape kergesti suktsinaatdehüdrogenaasi aktiivse saidiga, tõrjudes sealt välja substraadi, merevaikhappe. Ensüüm aga ei suuda seda teha maloonhappega, mis on 1 süsinikuaatomi võrra lühem. Seega, kui lisate maloonhapet kontsentratsioonis, mis ületab merevaikhappe kontsentratsiooni, siis reaktsioon peatub, kuna malonaat blokeerib suktsinaatdehüdrogenaasi aktiivse saidi.
Ravimitena kasutatakse sageli konkureerivaid inhibiitoreid. Näiteks antimikroobsed ravimid sulfoonamiidid on para-aminobensoehappe struktuursed analoogid, millest mikroorganismid sünteesivad paljunemiseks vajalikku B9-vitamiini (foolhapet). Paljud antibiootikumid pärsivad konkureerivalt valkude sünteesi mikroorganismide poolt või DNA replikatsiooni. Kasvajavastased ravimid (metotreksaat, vitamiini B9 antagonist) blokeerivad DNA replikatsiooni kasvajarakkudes.
Mittekonkureerivatel inhibiitoritel ei ole substraadiga struktuurilist sarnasust ja nad ei seondu aktiivse tsentriga, vaid teiste kohtadega, sealhulgas allosteerilise tsentriga. Inhibeerimine toimub ensüümi funktsionaalrühmade hävitamise või pöördumatu keemilise modifitseerimise tõttu. Näited:
a) alküülivad ained (jodoatseetamiid) reageerivad pöördumatult ensüümide SH rühmadega
E–SH + ICH2CONH2 → E–SCH2 –CONH2 + HI (ensüüm) (jodoatseetamiid) ensüümi inhibiitorite kompleks
b) FOS (fosfororgaanilised ühendid) preparaadid on väga mürgised mürgid putukatele ja soojaverelistele loomadele. Nad interakteeruvad seriini hüdroksürühmaga atsetüülkoliinesteraasi ensüümi aktiivses kohas:
c) teturam – atseetaldehüüddehüdrogenaasi inhibiitor (kasutatakse alkoholismi ravis).
Avaldamise kuupäev: 2015-11-01; Loe: 9258 | Lehekülg Autoriõiguse rikkumine | Telli paberi kirjutamine
veebisait - Studopedia.Org - 2014-2019. Studiopedia ei ole postitatud materjalide autor. Kuid see pakub tasuta kasutamist(0,005 s) ...Keela adBlock!
väga vajalik
Ensüümide toimet võivad teatud kemikaalid täielikult või osaliselt alla suruda (inhibeerida). - inhibiitorid (joonis 8).
Oma tegevuse olemuse järgi inhibiitorid jagunevad pöörduv ja pöördumatu. See jaotus põhineb inhibiitori ja ensüümi vahelise seose tugevusel.
Pöörduvad inhibiitorid on ühendused, mis mittekovalentselt interakteeruvad ensüümiga ja võivad ensüümist dissotsieeruda.
konkurentsivõimeline. Konkureeriv inhibiitor konkureerib substraadiga seondumise eest aktiivse saidi substraadi sidumissaidil ja seondub ensüümiga sarnaselt substraadiga. Kuid ensüümiga seotud konkureeriv inhibiitor ei muutu ensümaatiliselt. Konkurentsi inhibeerimise eripära on see, et seda saab nõrgendada või täielikult kõrvaldada substraadi kontsentratsiooni suurendamine. Paljud ravimid on konkureerivad ensüümi inhibiitorid.
Näide. Sulfa ravimid, mida kasutatakse nakkushaiguste raviks. Sulfoonamiidid on paraaminobensoehappe struktuursed analoogid, millest mikroorganismi rakus sünteesitakse koensüüm (H 4 - folaat), mis osaleb nukleiinsete aluste biosünteesis. Nukleiinhapete sünteesi rikkumine põhjustab mikroorganismide surma.
Pöörduv inhibeerimine võib olla mittekonkurentsivõimeline substraadi suhtes; sel juhul ei konkureeri inhibiitor substraadiga sama koha pärast ensüümis.
Mittekonkureeriv inhibiitor võib ensüümiga seonduda substraadi juuresolekul või puudumisel, substraadi kontsentratsiooni suurendamine ei takista inhibiitori seondumist (joonis 9). Mittekonkureeriv inhibiitor vähendab tegelikult aktiivse ensüümi kogust.
Seondumine viib ensüümi konformatsiooni muutumiseni ja substraadi komplementaarsuse katkemiseni. Mittekonkureerivad inhibiitorid võivad seonduda pöörduvalt nii vaba ensüümi kui ka ES kompleksiga. Olulisemad mittekonkureerivad inhibiitorid on elusrakus tekkivad vaheproduktid, mis võivad pöörduvalt seonduda ensüümide teatud kohtadega (allosteeriliste keskustega) ja muuta nende aktiivsust, mis on üks ainevahetuse reguleerimise viise.
Pöördumatud inhibiitorid - need on ühendid, mis võivad spetsiifiliselt siduda aktiivse tsentri teatud funktsionaalselt olulisi rühmi, moodustades kovalentsed, tugevad sidemed ensüümiga. Samal ajal seostuvad nad pöördumatult, sageli kovalentselt ensüümi või ensüüm-substraadi kompleksiga ja muudavad pöördumatult natiivset konformatsiooni. Mõnede toksiliste ainete toime põhineb ensüümi aktiivsuse pärssimisel, näiteks arseeniühendid, Hg 2+, Pb 2+
Näide Diisopropüülfluorofosfaat inhibeerib ensüüme, mille aktiivses kohas on seriin. Selline ensüüm on atsetüülkoliinesteraas, mis katalüüsib järgmist reaktsiooni:
Reaktsioon toimub iga kord, kui toimub närviimpulss, enne kui sünapsi kaudu edastatakse teine impulss. Diisopropüülfluorofosfaat on üks toksilisi närvimõjureid, kuna see põhjustab neuronite närviimpulsside juhtimise võime kaotust.
Näide. Aspiriini kui palaviku- ja põletikuvastase ainena terapeutilist toimet seletatakse sellega, et aspiriin inhibeerib üht ensüümi, mis katalüüsib prostaglandiinide (PG) sünteesi. Prostaglandiinid on ained, mis osalevad põletiku tekkes. Inhibeerimine on tingitud ensüümi ühe aminorühma - prostaglandiini süntetaasi - kovalentsest modifikatsioonist.
 Mittekonkureeriv pärssimine
Mittekonkureeriv pärssimine Muinasjutukangelaste entsüklopeedia: "Kääbiku nina"
Muinasjutukangelaste entsüklopeedia: "Kääbiku nina" Yunna Moritz: "Ma armastan oma riiki ja see on intravenoosne
Yunna Moritz: "Ma armastan oma riiki ja see on intravenoosne